ACTIVIDAD No. 1
a. VALENCIA: Capacidad de combinación que posee un átomo
ELECTRONES DE VALENCIA: Electrones del último nivel energético
ENLACE: Fuerza que une dos o más átomos en estado combinado
ELECTRONEGATIVIDAD: Tendencia que poseen los átomos para atraer y retener los electrones en un enlace químico.
b. En 1916, Walter Kossel y Gilbert Lewis concluyeron que la tendencia que poseen los átomos de lograr estructuras similares a la del gas noble más cercano explica la formación de los enlaces químicos.
Esta conclusión se conoce como "REGLA DEL OCTETO" que dice:
"Cuando se forma un enlace químico, los átomos reciben, ceden o comparten electrones de tal forma que la capa más externa de cada átomo contenga ocho (8) electrones, y así, adquiere la estructura electrónica del gas noble más cercano en el sistema periódico".
c. Una ESTRUCTURA DE LEWIS es la representación simbólica de cada elemento químico rodeada con los electrones presentes en la capa de valencia.
REGLAS:
- Escribir el número total de electrones de valencia, es decir, del último nivel de energía.
- Para cada enlace formado se debe considerar dos electrones.
- Todos los átomos deben quedar con ocho (8) electrones alrededor para completar el octeto. El Hidrógeno debe tener sólo dos (2) electrones.
ACTIVIDAD No. 2
a. Representa las fórmulas electrónicas y estructurales para las siguientes uniones químicas e indica el porcentaje de enlace para cada unión:
- Litio y Cloro
- Sodio y Fluor
- Calcio y Oxígeno
- Carbono y Azufre
- Hidrógeno y Bromo
- Azufre y Oxígeno
b. Pauling definió la Electronegatividad como: "La capacidad que tienen los átomos de atraer y retener los electrones que participan en un enlace químico"
c. Representa las fórmulas electrónicas y estructurales para las siguientes compuestos químicas e indica el porcentaje y el tipo de enlace para cada unión:
- O2
- CH4
- BeCl2
- MgO
- NaCl
d. Identifica en las siguientes parejas de elementos, el tipo de enlace que pueden formar. Escribe sus fórmulas y calcula el porcentaje de enlace para cada pareja.
- Sodio y Yodo
- Hidrógeno y Azufre
- Hidrógeno e Hidrógeno
- Flúor y Flúor
- Magnesio y Cloro
e. ¿Qué es la Polaridad de las Moléculas?
La Polaridad es la propiedad que tienen las moléculas de formar polos de carga debido a diferencias de electronegatividad entre los átomos que forman el enlace;
uno de los átomos tiende a atraer más los electrones del enlace, y por tanto se carga negativamente; el otro por el contrario, tiende a ceder los electrones del enlace y por eso se carga positivamente.
Es decir, si la diferencia de electronegatividad entre los átomos es notable se forman polos, mientras que si la diferencia de electronegatividad es igual a cero (0) no se forman polos.
Ejemplo:
- F - F En esta unión química la diferencia de electronegatividad es igual a cero, (4,0 - 4,0 = 0). La nube de carga está igualmente distribuida entre ambos átomos, por lo tanto no hay formación de polos. (nota: la imagen la explicará el docente en la clase)
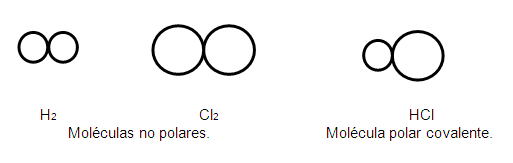
- H - Cl La diferencia de electronegatividad es igual a 0,7 (2,8 - 2,1 = 0,7). La nube de carga no se distribuye igualmente entre ambos átomos ya que el Cloro tiende a atraer más los electrones, formando así polos de carga positivos y negativos.
Los compuestos que presentan enlace covalente polar tienen puntos de fusión y ebullición altos, ya que establecen interacciones fuertes entre molécula y molécula debido a la atracción polar o de carga.
f. Enlace Covalente Polar: Este tipo de enlace presenta formación de polos de carga. Si la diferencia de electronegatividades es diferente de cero
Enlace Covalente Apolar: En este tipo de enlace no existe formación de polos. Se presenta entre átomos cuya diferencia de electronegatividad es igual a cero
 INSTITUCIÓN EDUCATIVA SANTO DOMINGO SAVIO
JAIRO ALBERTO BEDOYA ESCOBAR
AREA DE CIENCIAS NATURALES
INSTITUCIÓN EDUCATIVA SANTO DOMINGO SAVIO
JAIRO ALBERTO BEDOYA ESCOBAR
AREA DE CIENCIAS NATURALES